Como ya sabemos, el Alzheimer es una enfermedad neurodegenerativa que afecta a los procesos cognitivos de la corteza cerebral y el hipocampo y origina el olvido progresivo de las acciones que se realizan hasta llegar a demencia.
Los factores de riesgo para esta enfermedad son la edad, la diabetes y también hay relación genética.
Se sabe, además, que hay dos causas fundamentales que desembocan en esta enfermedad: la acumulación del péptido β-amiloide y la hiperfosforilación de la proteína TAU.
– EL PÉPTIDO β-AMILOIDE EN LA ENFERMEDAD:
Este péptido se forma por escisión secuencial de una proteína precursora llamada APP. En última instancia de corte interviene una γ-secretasa para formar el péptido. En función de las enzimas implicadas, el péptido formado tendrá su actividad normal o no: la vía no amiloidogénica comienza con la α-secretasa y posteriormente la γ-secretasa para dar lugar al péptido β-amiloide soluble y necesaria para el buen funcionamiento de las sinapsis neuronales. En la vía amiloidogénica, la primera enzima que actúa es la β-secretasa y después la γ-secretasa. El resultado de esta vía es un péptido β-amiloide insoluble que se acumula en los espacios interneuronales (hendiduras sinápticas) impidiendo la transmisión nerviosa. Por otro lado, no puede atravesar la barrera hematoencefálica y permanece formando agregados llamados placas amiloideas que no se pueden eliminar ni reducir. En el caso del péptido soluble, sí que se observa un equilibrio vía barrera hematoencefálica por lo que se cree que tiene funciones en otros tejidos del organismo.
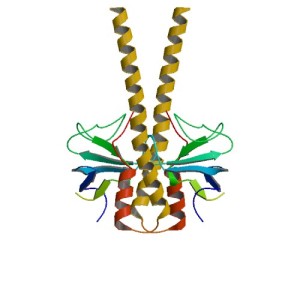
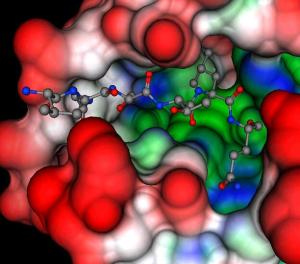
Aquí podemos observar la estructura tridimensional del péptido β-amiloide buscada en la base de datos RCSB PDB (Protein Data Bank):
– HIPERFOSFORILACIÓN DE LA PROTEÍNA TAU:
TAU es una proteína presente en gran cantidad en los microtúbulos de las neuronas y los ensambla y estabiliza. Los microtúbulos sirven para el transporte de vesículas que van cargadas con neurotransmisor que debe recambiarse. Pues bien, si hay una hiperfosforilación de esta proteína, se disocia de los microtúbulos y se forman agregados de esta proteína. Además, los microtúbulos se desestabilizan y empiezan a disociarse también, por lo que la función neuronal se ve gravemente afectada. Parece ser que este proceso de hiperfosforilación está motivado por la sobreexpresión de una enzima llamada glucógeno sintasa quinasa 3 (GSK-3), que la fosforila en múltiples sitios.
En esta imagen se observa el posible proceso de rotura de microtúbulos por presencia de la proteína TAU hiperfosforilada:
Lo que finalmente sucede es que las neuronas afectadas por ambas causas comienzan a perder su funcionalidad y las terminaciones dendríticas y axónicas se van reduciendo hasta desaparecer, ya que no son capaces de establecer sinapsis con las neuronas adyacentes.
Aquí tenéis un vídeo que ilustra ambas causas:
– LO QUE ADEMÁS SE SABE SOBRE EL ALZHEIMER ACTUALMENTE…
1. ¿Dónde se inicia en humanos?
Estudios demuestran en pacientes vivos que el Alzheimer se desarrolla en una zona de la corteza llamada entorrinal lateral, que contacta con el hipocampo, por lo que por ello se ve afectada esta última región, encargada de la memoria a largo plazo.
2. ¿Se ven afectadas otras zonas?
Estudios han demostrado que pueden verse afectadas otras zonas como la corteza parietal, que participa en la orientación espacial y la navegación. Puede tratarse de una propagación funcional, es decir, al destruir la función neuronal de la corteza entorrinal lateral, se ven afectadas las neuronas de las zonas adyacentes debido a que ya no reciben esa información.
3. ¿Por qué se produce el Alzheimer?
La corteza entorrinal lateral sufre esta enfermedad porque normalmente se acumula la proteína TAU en esta región y ello provoca que se sensibilice a acumular el péptido β-amiloide insoluble, es decir, el Alzheimer aparece cuando hay cambios en la proteína TAU y el péptido β-amiloide de forma conjunta.
– UNOS RECEPTORES INTERESANTES: P2X7…
El ATP se trata de un nucleótido fundamental para el organismo, ya que constituye la moneda energética y es necesaria para multitud de procesos metabólicos. Sin embargo, ahora se sabe que además actúa como molécula señalizadora y que es el mensajero químico de los receptores P2X7, encontrados en la terminal presináptica, lo que da un giro inesperado a lo que se sabía de la transmisión de los impulsos nerviosos y un avance positivo para esta enfermedad. El ATP es pues, el mediador de la transmisión a nivel presináptico.
Los receptores P2X7 son ionotrópicos situados fundamentalmente en el cerebelo, que actúan como canales de entrada de Na+ y Ca2+, de modo que se convierten en esenciales para la liberación del neurotransmisor que se encuentra en el interior de vesículas secretoras.
Al situarse a nivel presináptico, si se llegara a controlar la función presináptica, se podrían tratar enfermedades que se derivan en fallos a ese nivel, como el Alzheimer, en la que existe un déficit o una disminución de la secreción de acetilcolina. En ese caso, se podría intervenir mediante el desarrollo de agonistas que estimularan esa secreción.
Además, estos receptores se encuentran también a lo largo del axón y regulan el avance del potencial de acción. Por tanto, mediante antagonistas para estos receptores, se podría llegar a provocar la regeneración nerviosa cuando las células gliales provocan obstrucción axónica por inflamación.
En un estudio de estos receptores, se sabe que su inhibición da lugar a un incremento de la actividad de la α-secretasa a través de la inhibición de la glucógeno sintasa quinasa 3 (GSK-3), reduciéndose el número de placas amiloideas.
El péptido β-amiloide insoluble es capaz de interactuar con receptores de insulina o frizzled y aumentar la actividad de la GSK-3, lo que mejora la producción de este péptido y además provoca la hiperfosforilación de TAU.
Por tanto, no solo es importante el crecimiento del axón y las dendritas de una neurona de forma adecuada para contactar con otras neuronas, sino también las moléculas que actúan de mensaje para promover el desarrollo posterior de transmisiones nerviosas efectivas.
– MI QUERIDA VITAMINA E…
Parece que el año 2014 nos empieza aportando avances positivos sobre esta enfermedad. Un estudio muy reciente señala que en pacientes que se encuentran en estadios iniciales de la enfermedad, una elevada dosis de vitamina E retrasa la patología.
Y la pregunta es…¿entonces tomamos vitamina E para tener el nivel adecuado y así prevenimos la enfermedad? La respuesta es NO. Según este estudio estadounidense, a los pacientes se les administró una cantidad mucho mayor del nivel de vitamina E diario recomendado, por lo que no se trata de mantener el nivel normal, sino de sobrepasarlo y tratar a la vitamina E como un fármaco. Pero esto es solo un estudio, aún es pronto para saber si va a dar un resultado positivo en el 100% de los casos. Además, solo es válido para pacientes que comienzan a padecer los primeros síntomas de Alzheimer, por lo que aún queda mucho por recorrer para aquellos que siguen luchando contra esta enfermedad.
Y por último y a nivel personal, creo que debemos cumplir con las dosis recomendadas para el organismo de todas las vitaminas y demás nutrientes esenciales porque es posible que suframos de otras patologías y malestares por prevenir y pensar que tomando exceso de vitamina E , ya no nos va a pasar nada. Pero por supuesto, a nivel médico y con el control adecuado, ¡¡es una gran noticia!!
Por cierto, ¡la vitamina E se encuentra en frutos secos y semillas de vegetales! ;)
¡Espero que os haya gustado y que con vuestros comentarios se vuelva más interesante este artículo!
Mª Fuensanta López Marín